
Mikro cząsteczki srebra a tynki mineralne
Wpływ dodatku bioaktywnych mikro cząsteczek srebra na właściwości użytkowe tynków mineralnych.
Aktywność mikroorganizmów, a przede wszystkim bakterii i grzybów w istotny sposób wpływa na swoiste cechy i wartość użytkową materiałów (drewno, wyroby papierowe, tworzywa sztuczne, ceramiczne materiały budowlane, farby i lakiery) narażonych na kontakt z drobnoustrojami. Zjawisko wywołane rozwojem grzybów określa się mianem biodeterioracji pleśniowej. Jest to rodzaj korozji biologicznej (stanowiącej szczególny przypadek korozji chemicznej), która powoduje obniżenie lub utratę właściwości użytkowych materiału w wyniku sumowania się dwóch niekorzystnych procesów: mykotoksycznego skażenia środowiska oraz biodegradacji [1]. Biokorozja materiałów technicznych zachodzi wtedy, gdy zaistnieją warunki sprzyjające intensywnemu rozwojowi mikroorganizmów.
Grzyby, jako organizmy heterotroficzne, zasiedlające różnorodne środowiska, odgrywają wiodącą rolę w procesie rozkładu materii organicznej i globalnym obiegu pierwiastków. Dobrze rozwijają się tam, gdzie mają dostateczną ilość substancji odżywczych, optymalną wilgotność (ok. 70%), odpowiednią temperaturę i środowisko o pH = 5,6 – 6,5 [2]. Na rozwój określonych gatunków tych mikroorganizmów wpływa również charakter i właściwości podłoża (zawartość różnych minerałów, zasolenie) [3].
Inicjacji i rozwojowi korozji biologicznej towarzyszy tworzenie się tzw. biofilmu, czyli złożonej struktury o konsystencji hydrożelu przylegającego do powierzchni. Jego powstanie inicjują tylko niektóre bakterie wiążące się z powierzchnią materiałów siłami van der Waalsa. Powstający biofilm jest dogodnym siedliskiem dla mikroorganizmów gdyż charakteryzuje się chropowatą, niejednolitą mikrostrukturą, z licznymi ujściami porów. W porach zachodzi kondensacja pary wodnej, a po wyeksponowaniu na działanie czynników zewnętrznych pokrywa się osadem substancji nieorganicznych i organicznych. Ponadto śluz bakteryjny, wydzielany przez komórki bakterii inicjujących powstanie biofilmu jest nie tylko podłożem sprzyjającym rozwojowi bakterii, grzybów i glonów, ale tworzy również warstwę chroniącą zasiedlające go mikroorganizmy [4].
Mikroorganizmy występujące zarówno na powierzchni materiałów budowlanych jak i w ich wnętrzu (pory), mogą być przyczyną procesów ich niszczenia na skutek wydzielania enzymów i produktów metabolizmu [4]. W wyniku bytowania mikroorganizmów wytwarzają się błony biologiczne wpływające na zmianę porowatości z wytworzeniem mikropęknięć związanych ze zmianami dyfuzji pary wewnątrz materiału. Zjawiska te są powodowane przez zewnątrzkomórkowe substancje polimerowe (ang. extracellular polymeric substances; EPS) oraz związki zmniejszające napięcie powierzchniowe, wydzielane do środowiska przez mikroorganizmy [5]. Materiały pochodzenia organicznego ulegają rozkładowi w wyniku pobierania przez grzyby organicznych substancji pokarmowych [6]. Inną aktywnością cechują się drobnoustroje zasiedlające typowo nieorganiczne materiały budowlane, bowiem wytwarzając kwaśne metabolity (kwas szczawiowy, glukonowy, cytrynowy) kompleksujące jony Ca2+ i Mg2+, powodują wymywanie tych pierwiastków, a tym samym poważne osłabienie struktury materiału [7]. Problem ten dotyczy szczególnie zawilgoconych obiektów budowlanych, w których kształtuje się specyficzny mikroklimat sprzyjający rozwojowi destrukcyjnej mikroflory oraz szkodników biologicznych.
Grzyby, które najczęściej spotyka się w różnego typu obiektach budowlanych zaliczane są do rodzajów: Aspergillus sp., Penicillium sp., Fusarium sp., Candida sp., Alternaria sp. oraz Cladosporium sp. [8], w dwojaki sposób oddziałują na otoczenie. Oprócz korozji biologicznej materiałów budowlanych mogą również stwarzać zagrożenie dla zdrowia użytkowników zasiedlonych obiektów [6]. Toksyczne oddziaływanie grzybów na zdrowie ludzi i zwierząt uważa się za znacznie groźniejsze w skutkach od biokorozji materiałów [9,10]. Wiele gatunków wytwarza szkodliwe mykotoksyny (np. aflatoksyny), których już nawet jednorazowa dawka prowadzi do nieodwracalnych, przedrakowych i nowotworowych zmian w wątrobie czy efektu teratogenicznego u rozwijających się płodów. Do innych schorzeń będących konsekwencją przebywania w zagrzybionych pomieszczeniach należą: alergiczny nieżyt błony śluzowej nosa, astma oskrzelowa, zmiany skórne o charakterze grzybic, alergiczne zapalenie pęcherzyków płucnych oraz alergie pokarmowe [2]. Jednak szkodliwy wpływ na zdrowie ludzi mogą mieć także biocydy stosowane do impregnacji i odgrzybiania różnego typu materiałów [11]. Przedstawione kwestie powodują, że obiektom budowlanym, jak i materiałom dopuszczonym do ich ochrony, stawia się odpowiednie wymagania w zakresie higieniczno-sanitarnym oraz w sferze odporności na korozję biologiczną, które formułowane są w postaci aktów prawnych (Prawo budowlane, dyrektywa Rady Wspólnot Europejskich) [6].
Na rynku znajduje się wiele preparatów przeznaczonych do odgrzybiania różnego typu materiałów. Jednakże chemiczne metody zwalczania pleśni z wykorzystaniem biocydów nie są powszechnie akceptowane ze względu na stosunkowo niedługi okres ochrony, związany z mechanizmami odpornościowymi mikroorganizmów oraz stąd konieczność powtarzania zabiegu nanoszenia powłoki ochronnej [12]. Nie bez znaczenia pozostaje także toksyczność i niekorzystny wpływ tych środków na środowisko oraz ludzkie zdrowie [13]. Na podstawie badań oceny skuteczności zabiegów dezynfekcyjnych w zwalczaniu grzybów pleśniowych opisanych przez Janińską udowodniono, że zastosowanie biocydu do zwalczania grzybów pleśniowych na powierzchni materiałów budowlanych nie daje gwarancji jego długoterminowej skuteczności. Efekt ten można uzyskać jedynie w wyniku wielokrotnego powtarzania zabiegu dezynfekcyjnego [14].
Badania nad procesami korozji i poprawy trwałości materiałów budowlanych (w tym materiałów betonowych i tynków) są istotne z punktu widzenia szeroko pojętej ochrony środowiska i zrównoważonego budownictwa. Przykładowe obrazy mikroskopowe [rys.1], wykonane za pomocą skaningowego mikroskopu elektronowego, z badań mikrostruktury i składu tynków i pobiału w pomieszczeniu korpusu dawnego Pałacu Biskupów Krakowskich w Kielcach wskazują na postępujący proces biokorozji tych materiałów. Deterioracja w odniesieniu do materiałów budowlanych postępuje co prawda w większości przypadków stopniowo oraz z niewielką szybkością, jednakże jej skutki prowadzić mogą do poważnych katastrof budowlanych [4].
Rys. 1. Obraz mikroskopowy (SEM) śladów agresji biologicznej a) tynk wapienny z warstwy powierzchniowej, b) pobiał wapienny.
Od wielu lat do zwalczania bądź zahamowania wzrostu mikroorganizmów wykorzystuje się metale ciężkie w postaci soli bądź związków organicznych. Jednakże, ze względu na udowodnioną toksyczność, jaką związki te wykazują w stosunku do organizmów ludzi czy zwierząt, dąży się do całkowitego wycofywania ich z użycia [15]. Poszukiwania środków bójczych skierowane są obecnie na dodatki metali o dużym stopniu rozdrobnienia [16, 17]. Zaletą tzw. układów „nano” jest bardzo rozwinięta powierzchnia właściwa (aktywność biologiczna zapewniona nawet przy małych stężeniach dodatków) oraz możliwość uzyskania homogenicznych układów [18].
Powszechnie znana z literatury jest aktywność biobójcza cząstek srebra [19]. Dyskusyjnym pozostaje jednak to, czy większą skuteczność wykazuje srebro na zerowym stopniu utlenienia czy w postaci jonowej. Badania opisane w [2] pokazują, że jony cząstek srebra, stosowane zwłaszcza w postaci nanocząstek, wykazują lepsze działanie inhibitujące wzrost mikroorganizmów. Mechanizm hamujący aktywność mikroorganizmów pod wpływem działania cząstek Ag nie został całkowicie poznany [21, 22], ale jak podaje literatura w przypadku nanocząstek srebra prawdopodobnie jest to wynikiem procesów związanych z uszkadzaniem błony komórkowej [21].
Rozwój nanotechnologii wymógł jednak konieczność badań toksykologicznych w zakresie szkodliwości nanocząstek dla środowiska oraz zdrowia człowieka. Najwięcej obaw związanych z wymiarem „nano” wynika z braku w organizmie człowieka barier ograniczających przemieszczanie się cząstek o wymiarze zwłaszcza poniżej 10 nm. Nanocząstki mogą swobodnie przenikać przez błony komórkowe (głównie mitochondriów [23, 24]) i migrować w organizmie do różnych narządów, w nich ulegać depozycji i wywoływać szkodliwe skutki zdrowotne. Swobodnej migracji sprzyja również fakt, że są one słabo wychwytywane przez układ immunologiczny [25]. Oznacza to, że istnieje realne zagrożenie związane z niekontrolowanym obiegiem nanocząstek w środowisku naturalnym oraz wnikaniem do organizmu ludzkiego.
Mając powyższe uwagi na względzie, zaproponowano i wstępnie przebadano rozwiązanie, w którym właściwości bójcze sprawowałyby cząsteczki metalicznego srebra o wymiarach mikrometrów. Ich oddziaływanie na ograniczenie rozwoju mikroorganizmów sprawdzono na typowej zaprawie wapienno-cementowej, predysponowanej jako najczęściej stosowane wykończenie zewnętrzne budynków. Zaprawa ta, implantowana cząsteczkami srebra, w proponowanym rozwiązaniu stanowiłaby barierę zabezpieczającą konstrukcję i wewnętrzną część budynku przed agresją biologiczną. W opinii autorów niniejszego opracowania, dotychczas stosowane zabezpieczenia w postaci farb elewacyjnych zawierających biocydy lub nanocząsteczki srebra nie są w pełni satysfakcjonujące.
W opisywanym eksperymencie wytworzono próbki typowej zaprawy wapienno-cementowej implantowanej (powierzchniowo lub w masie) cząsteczkami srebra o wymiarach mikrometrycznych. Badano wpływ tych operacji technologicznych na wybrane właściwości fizyczne zapraw, oraz przede wszystkim na ich odporność na agresję biologiczną.
Przygotowanie próbek.
Próbki do badań wykonane zostały w formie prostopadłościanów 160x40x40, zgodnie z metodyką opisaną w normie PN-85/B-04500 „Zaprawy budowlane. Badania cech fizycznych i wytrzymałościowych”. Skład badanych zapraw podano w Tabeli 1. Próbki poddano testom po 90 dniach od ich uformowania.
Tabela 1. Receptury otrzymywania badanych zapraw.
| Surowce | Zaprawa bazowa | Zaprawa implantowana Ag. |
| Piasek kwarcowy < 1 mm | 4000 g | 4000 g |
| Wapno hydratyzowane | 600 g | 600 g |
| Cement portlandzki CEM I 32,5 | 200 g | 200 g |
| Woda | do konsystencji 170 mm | Do konsystencji 170 mm |
| *GAg10 | 7% suchej mieszanki |
*GAg10 – grunt srebrzący, zawierający żywicę syntetyczną z 0,32% wag. srebra.
Powierzchnie wybranych próbek badanych zapraw, malowano 1- lub 2- krotnie (po 72 h) gruntem srebrzącym GAg10 i suszono. W Tabeli 2 podano oznaczenia próbek i szczegółowy ich opis.
Tabela 2. Oznakowanie próbek.
| Oznakowanie | Opis próbek |
| K | Zaprawa bazowa, nie malowana. |
| K1x | Zapr. Baz., 1- krotnie malowana, zużycie GAg10 – 222 g/m2 |
| K2x | Zapr. Baz., 2- krotnie malowana, zużycie GAg10 – 115 g/m2 (w drugiej warstwie) |
| ZAgK | Zaprawa z GAg10 w masie, nie malowana. |
| ZAgK1x | Zaprawa z GAg10, 1- krotnie malowana, zużycie GAg10 – 191 g/m2 |
| ZAgK2x | Zaprawa z GAg10, 2-krotnie malowana, zużycie GAg10 – 90 g/m2 (w drugiej warstwie) |
Oznaczenia wybranych właściwości fizycznych badanych zapraw.
Badania porównawcze stwardniałych próbek zapraw, opisanych w Tabeli 1 i Tabeli 2, prowadzono zgodnie z metodyką zawartą w PN-85/B-04500 „Zaprawy budowlane. Badania cech fizycznych i wytrzymałościowych”. Ograniczono się do następujących oznaczeń:
– wytrzymałość na zginanie i ściskanie po 90 dniach dojrzewania
– gęstość w stanie wysuszonym
– nasiąkliwość zaprawy suchej
– podciąganie kapilarne
– współczynnik rozmiękania przy zginaniu Kz,
Wyniki badań zestawiono w tabelach 3 do 5.
Tabela 3. Właściwości fizyczne badanych zapraw.
| Oznakowanie | Gęstość objętościowa rs, [kg/m3] | Nasiąkliwość, [%] masy. | Wytrzymałość na ściskanie Rs, [MPa] | Wytrzymałość nazginanie Rz, [MPa] |
| K | 1782 | 15,8 | 0,82 ± 0,06 | 0,58 ± 0,04 |
| K1x | 1736 | 15,5 | 0,79 ± 0,06 | 0,62 ± 0,02 |
| K2x | 1729 | 15,9 | 0,77 ± 0,03 | 0,63 ± 0,03 |
| ZAgK | 1780 | 14,6 | 0,84 ± 0,02 | 0,65 ± 0,05 |
| ZAgK1x | 1762 | 13,9 | 0,82 ± 0,04 | 0,62 ± 0,02 |
| ZAgK2x | 1720 | 14,2 | 0,74 ± 0,03 | 0,61 ± 0,03 |
Tabela 4. Podciąganie kapilarne.
| Oznakowanie | Przyrost masy próbek [%] | |||
| po 1h | po 3h | po 6h | po 24 h | |
| K | 6,9 | 11,2 | 14,6 | 15,6 |
| K1x | 6,5 | 9,9 | 12,8 | 15,3 |
| K2x | 6,6 | 10,1 | 12,7 | 15,4 |
| ZAgK | 4,1 | 6,2 | 8,2 | 13,2 |
| ZAgK1x | 2,1 | 4,2 | 9,1 | 11,2 |
| ZAgK2x | 4,4 | 7,4 | 9,7 | 14,5 |
Tabela 5. Współczynnik rozmiękania przy zginaniu Kz.
| Oznakowanie | Rzs, próbki suche, [MPa] | Rzm, próbki mokre, [MPa] | Kz=Rzm/Rzs |
| K | 0,58 ± 0,04 | 0,24 ± 0,01 | 0,41 |
| K1x | 0,62 ± 0,02 | 0,28 ± 0,01 | 0,45 |
| K2x | 0,63 ± 0,03 | 0,27 ± 0,02 | 0,43 |
| ZAgK | 0,65 ± 0,05 | 0,36 ± 0,02 | 0,56 |
| ZAgK1x | 0,62 ± 0,02 | 0,32 ± 0,02 | 0,52 |
| ZAgK2x | 0,61 ± 0,03 | 0,32 ± 0,01 | 0,53 |
Analiza wpływu dodatku gruntu srebrzącego GAg10 zawierającego żywicę syntetyczną na zmianę mikrostruktury próbek.
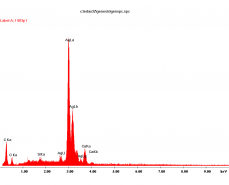
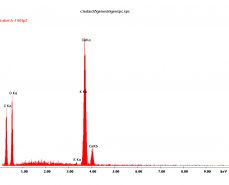
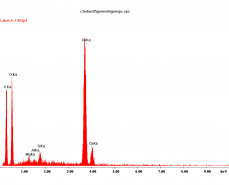
Badania mikrostruktury wybranych próbek przeprowadzono na nisko próżniowym mikroskopie skaningowym (SEM), wyposażonym w mikroanalizator rentgenowski ISIS. Przełomy badanych próbek nie były napylane materiałem przewodzącym. W związku z tym aglomeraty cząstek metalicznego srebra (przewodzące) „świeciły” i prezentują się na poszczególnych mikrofotografiach jako białe plamy, co ułatwia ich identyfikację na powierzchni ceramicznej (nieprzewodzącej) matrycy.
Poniżej prezentujemy wyniki badań prowadzonych na przełomach próbek.
 |
 |
 |
|
 |
Rys.2. Mikrostruktura (SEM) zaprawy oznaczonej jako K1x, a więc zaprawa kontrolna malowana powierzchniowo syntetyczną żywicą zawierającą cząsteczki metalicznego srebra.
Dla zaprawy kontrolnej jednokrotnie powierzchniowo pomalowanej syntetyczną żywicą zawierającą cząstki metalicznego srebra (K1x) wykonano rentgenowską analizę pierwiastkową ISIS w punktach oznaczonych na mikrofotografii SEM (Rys. 2) cyframi 1, 2, 3. W jej wyniku możemy stwierdzić, że w badanej zaprawie ziarna piasku spojone są produktami hydratacji, a następnie karbonatyzacji cementu portlandzkiego i wapna hydratyzowanego, a więc głównie węglanu wapniowego (pkt. 2) z domieszkami glinokrzemianów (pkt.3). Implantowane (powierzchniowo w tym przypadku) cząsteczki metalicznego srebra widoczne są jako białe plamy, co potwierdzają wyniki mikroanalizy wykonanej w pkt.1.
Na prezentowanych poniżej mikrofotografiach SEM, obserwujemy przełomy próbek zapraw implantowanych w masie żywicą syntetyczną zawierającą cząsteczki metalicznego srebra, na których widoczne są białe punkty pochodzące od Ag (Rys. 3). W próbkach dodatkowo malowanych gruntem GAg 10 (Rys. 4 i Rys. 5), oprócz cząstek srebra występujących w całej objętości zaprawy, obserwujemy dodatkowo ich występowanie na powierzchni.
| Rys 3. Próbka ZAgKFig. | Rys. 4. Próbka ZAgK1xFig. |
Rys. 5. Próbka ZAgK2xFig. |
Badania porównawcze odporności testowanych zapraw na agresję biologiczną.
Doświadczenie, sprawdzające aktywność fungistatyczną zaprawy implantowanej gruntem srebrzącym wobec grzyba Trichoderma koningii, przeprowadzono w 250-ml, septycznych pojemnikach szklanych z użyciem standardowej pożywki glukozowo–ziemniaczanej. Eksperymenty zakładano w sterylnym podłożu (20 cm3) zestalonym agarem, które szczepiono poprzez dyspersję powierzchniową 5,5 cm3 inokulum będącego zawiesiną zarodników testowanego grzyba w płynnej pożywce. Stężenie zarodników w inokulum wynosiło 105 cfu/cm3. Następnie, na powierzchni tak przygotowanych podłoży umieszczano badane materiały i zamykano pojemniki w celu ograniczenia kontaminacji mikrobiologicznej badanych układów. Każdy eksperyment prowadzono przez trzy tygodnie. Po tym czasie, bazując na obserwacji makroskopowej – wizualnej ocenie wzrostu grzybni, w odniesieniu do odpowiedniej próby kontrolnej (zaprawy bazowej), określano podatność badanego materiału na zasiedlanie przez Trichoderma koningii, a równocześnie oceniano wrażliwość testowanego szczepu na obecność analizowanego dodatku.
Badania przeprowadzono w dwóch układach eksperymentalnych, z których każdy zawierał bazowe próby tynków (kontrola) oraz próby zawierająca dodatek srebra (Ag). Układy te różniły się kształtem badanych tynków (nieregularny lub krążki) oraz ich pochodzeniem i wiekiem tynków (stary tynk ok. 20-letni był jednokrotnie malowany z jednej strony gruntem srebronośnym o stężeniu wagowym srebra 0,32%, natomiast krążki – to nowa zaprawa tynkarska, gdzie do cieczy zarobowej dodano grunt srebronośny tak, że stężenie wagowe srebra w całości wynosiło 0,02%).
Wyniki eksperymentów potwierdziły, iż w przypadku stosowania dodatku Ag, rozwój grzybni zostaje znacząco ograniczony. Wizualna ocena wzrostu grzybni po upływie 3 tygodni, dokonana dla obu układów eksperymentalnych (Rys. 6, Rys. 7), potwierdza istotny efekt fungistatyczny. Jest on bardziej wyraźny dla krążków tynków (Rys. 7), niż dla próbek tynków o nieregularnych kształtach, pochodzących ze starego budownictwa. W tym przypadku dodatkowo zaobserwowano, że prócz właściwej grzybni Trichoderma koningii, w podłożu rozwinęły się również inne grzyby strzępkowe, tworząc grzybnię o odmiennym, niż Trichodermy koningii, kolorze strzępki i strukturze.
|
Rys. 6. Obraz makroskopowy trzytygodniowych hodowli grzyba Trichoderma koningii towarzyszących a) zaprawie bazowej b) próbkom tynków zawierających dodatek Ag na połowie eksponowanej powierzchni.
|
|
Rys. 7. Obraz makroskopowy trzytygodniowych hodowli grzyba Trichoderma koningii towarzyszących a) zaprawie bazowej b) próbkom tynków zawierających dodatek gruntu srebronośnego
Podsumowanie wyników badań.
Malowanie powierzchni próbek zapraw srebronośnym gruntem GAg10, jak i wprowadzenie go jako składnika zestawu surowcowego przy otrzymywaniu badanych zapraw, nie wpłynęło w sposób istotny na ich własności mechaniczne. Zaobserwowano natomiast różnice (korzystne w porównaniu do zaprawy bazowej) na zmianę niektórych ich właściwości związanych z wtórnym kontaktem z woda, a mianowicie:
– nasiąkliwość zapraw zawierających w swojej objętości grunt GAg10 uległa nieznacznemu zmniejszeniu.
– dodatek gruntu GAg10 do badanych zapraw wapienno cementowych, spowodował istotne obniżenie mierzonych wartości podciągania kapilarnego, zwłaszcza w pierwszych 6 h testu.
– współczynnik rozmiękania przy zginaniu (Kz), w przypadku próbek wytworzonych z dodatkiem GAg10 wykazywały wyższe wartości. Malowanie powierzchni próbek nie miało istotnego wpływu.
Przeprowadzono badania aktywności fungistatycznej zaprawy implantowanej gruntem srebrzącym wobec wybranego grzyba Trichoderma koningii. Rezultaty hodowli grzyba w przypadku próbek tynków z naniesionym srebrem odnoszono do odpowiedniej kontroli wykonanej dla zaprawy bazowej. Badania przeprowadzone z użyciem zapraw tynkowych implantowanych srebrem wykazały, iż obecność Ag wywiera wyraźny wpływ na ograniczenie rozwoju grzybni, co potwierdza, zgodną z danymi literaturowymi, biobójczą aktywność tego pierwiastka także w proponowanych w tej pracy układach zapraw tynkarskich.
Podziękowania
Praca badawcza współfinansowana przez Unię Europejską z Europejskiego Funduszu Rozwoju Regionalnego, w ramach projektu „Opracowanie i wdrożenie na rynek biobójczego preparatu gruntującego” nr POIG.01.04.00-16-007/11-00 realizowanego w Programie Operacyjnym Innowacyjna Gospodarka 2007-2013.
Joanna Barton jest stypendystką projektu „Stypendia doktoranckie – inwestycja w kadrę naukową województwa opolskiego” współfinansowanego przez Unię Europejską w ramach Europejskiego Funduszu Społecznego.
Wojciech Spisak, Krystyna Czaja, Joanna Barton, Marek Petri
Literatura
- Nabrdalik M., Mikologia Lekarska 14(3), (2007), 195-200.
- Wołejko E., Matejczyk M., Civil and Environmental Engineering Reports/ Budownictwo i Inżynieria Środowiska, 2, (2011), 191-195.
- Nuhoglu Y., Oguz E., Uslu H., Ozbek A., Ipekoglu B., Ocak I., Hasenekoglu I. Total Environ., 364, (2006), 272-283.
- Nocuń-Wczelik W.: „Oddziaływanie mikroorganizmów na zaczyn cementowy – korozja- mechanizmy samo naprawcze”; X Ogólnopolska Konferencja „Korozja 2011”, Rytro 2011, Ochrona przed Korozją, LIV, (6/2011), 316-318.
- Grossi C. M., Brimblecombe P. Mat. Constr., 58, (2008), 143-160.
- Janińska B., Foundations of Civil and Environmental Engineering, 3, Wyd. Politechniki Poznańskiej, (2002), 47—64.
- Żakowska Z.: „Mikroorganizmy w procesie biodeterioracji i biodegradacji materiałów technicznych” w Materiały IV Międzynarodowej Konferencji Naukowej. „Rozkład i korozja mikrobiologiczna materiałów technicznych, Łódź, (2006), 12-15.
- Guiamet P. S., Rosato V., Gómez de Saravia S., García A. M., Moreno D. A. Cult. Herit., 13, (2012), 339-344.
- Andersson M.A., Nikulin M., Koljalg U., Andersson M.C., Rainey F., Reijula K., Hintikka E.L., Salkinoja-Salonen M., Environ. Microb., (1997), 387-393.
- Matthew c. Fisher, Daniel A. Henk, Cheryl J Briggs, John S. Brownstein, Lawrence C. Madoff, Sarah L. McCraw, Sarah J. Gurr, Nature 484, (2012), 186-194.
- Ważny J. Mat. X Konf. „KONTRA’96” Trwałość budowli i ochrona przed korozją, Zakopane,1996, 267-273.
- Russel A.D., Chopra I., Understanding Antibacterial Action and Resistance. Horwood Ltd, Chichester (1990).
- Tiano P. Techn. Cult. Herit., 7, (1998),19-38.
- Janińska B., Materiały budowlane, 364, (2002), 56-59.
- Ślusarczyk A., Kuczyńska H., Polimery, 49, (2004), 587.
- Sharma V.K., Yngard R.A., Lin Y., Colloid Interfac. 145, (2009), 83.
- Roth P.J., Theato P., Mater., 20, (2008), 1614.
- Sionkowski G., Kaczmarek H., Polimery, 55, (2010), 545.
- Cioffi N., Torsi L., Sitaranto N., Ditaranto N., Tantillo G., Ghibelli L., Sabbatini L., Zamboni P.G., D’Alessio M., Bleve-Zacheo T., Traversa E., Phys., 85, (2004), 2417-2419.
- Jeon H-J., Yi S-Ch., Oh S-G., Biomaterials, 24, (2003), 4921.
- Egger S., Lehmann R.P., Height M.J., Loessner M.J., Schuppler M., Environ.l Microb., 75, (2009), 2973-2976.
- Fatexia S., Neves M.C., Almaeida A., Oliveira J., Trindade T., Colloid Surface B, 74, (2009), 304-308.
- Hoet P., Bruske-Hohlfeld I., Salata O., Nanobiotechno. 2, (2004), 12-37.
- Huang M., Knor E., Lim L., Res., 21, (2004), 344-353.
- Zatorski W., Zapór L., Jankowska E., Kompozyty, 10, (2010), 3-10.









